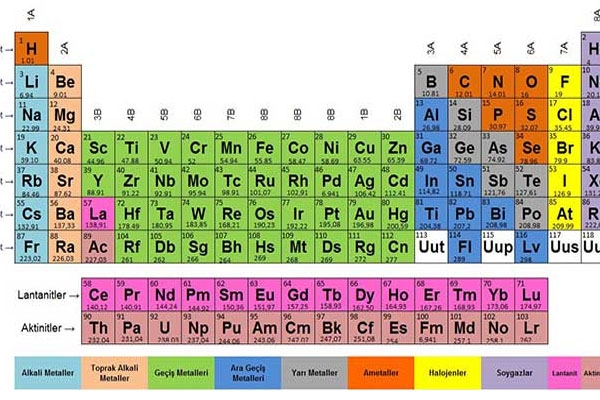
Böylece elementler daha kolay öğrenilebilir hale gelmişlerdir.
Geçmişten Günümüze Periyodik Tablo
Johann Döbereiner
Döbereiner, elementleri Li-Na-K, Cl-Br-I, Ca-Sr-Ba gibi gruplara ayırmıştır.
Alexandre Beguyer de Chancourtois
Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir.
John Newlands
Lothar Meyer
Dimitri İvanovic Mendeleyev
Henry Moseley
Henry elementlerin sıralamasını artan proton sayısına(atom numarası) göre yapmıştır.
Deneysel olarak atom numaralarını ispatlamıştır.
Periyodik Sistem Periyot
1. Soldan sağa doğru gidildikçe atom numarası (proton sayısı) artmaktadır.
2. Periyotlarda soldan sağa doğru elektron alma isteği artar.
Periyodik Sistem Grup
Periyodik sistemde 18 tane grup vardır. Bu gruplardan 8 tanesi A grubu 10 tanesi de B grubu olarak adlandırılmışlardır.
Yukarıdan aşağı doğru inildikçe atom numarası artar.
Bir elementin elektron dağılımı yapıldığında son yörüngesinde kalan elektron miktarı bize grup numarasını verir.
Metaller
Genellikle oda şartlarında katı haldedirler. (civa hariç)
Elektriği ve ısıyı iyi iletirler.
Dövülerek şekil verilebilirler ve üzerlerine vurulduğunda çınlama sesi çıkar.
Dayanıklı, ağır ve parlaktırlar.
Elektron vermeye yatkındırlar.
Kendi aralarında bileşik yapmazlar sadece ametallerle iyonik bağlı bileşik oluştururlar.
İyon halindeyken (+) pozitif (katyon) yüklüdürler.
Yarı Metaller
Fiziksel olarak metallere kimyasal olarak da ametallere benzerler.
Metaller kadar elektriği ve ısıyı iyi iletmezler(yarı iletken).
Oda koşullarında katı bulunurlar. Parlaklıkları metaller kadar değildir.
Zor da olsa tel ve levha haline getirebilir. Kırılgan değildirler.
Elektron almaya yatkındırlar. Metallerle iyonik bağ, ametallerle kovalent bağ yaparlar.
Ametaller
Elektrik ve ısıyı iyi iletmezler. Yalıtkan ve izolasyon malzemesi olarak kullanılabilirler.
Kırılgandırlar bu yüzden şekil verilemezler (yani tel veya levha haline getirilemezler).
Görünümleri mattır.
Elektron almaya yatkındırlar.
Kendi aralarında kovalent bağlı ve metallerle iyonik bağlı bileşik yapabilirler.
İyon halindeyken (-) negatif (anyon) yüklüdürler.
Soygazlar

Soygazlar 8A grubunda bulunan ametallerin bir alt grubudur. Diğer ametallerden bazı farklı özelliklere sahiptirler.
Parlak değildir.
Oda sıcaklığında tek atomlu gaz halindedir.
Tel ve levha haline getirilemezler.
Kararlı yapıda oldukları için elektron alışverişi yapmazlar ya da elektronlarını ortaklaşa kullanmazlar.
Kararlı yapıda oldukları için hiçbir elementle bileşik oluşturmazlar.
İlk 18 element içerisindeki soygazlar He, Ne ve Ar’dir.
Kimyasal Bağlar
Maddelerdeki atomları bir arada tutan çekim kuvvetine kimyasal bağ denir.
Kimyasal bağ gerçek bir bağ değildir. Kimyasal bağ sadece bir kuvvet veya etki sonucu oluşan bir çekim kuvvetidir.
Kimyasal Bağ Neden oluşur?
İyonik Bağ
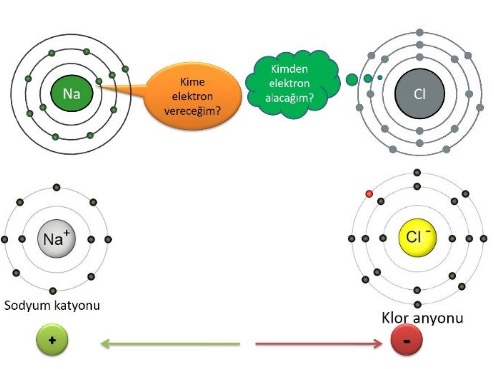
İyonik bağ atomların elektron alış verişi sonucunda oluşan kimyasal bağdır.
İyonik bağın olabilmesi için atomlardan birinin elektron vermeye diğerinin almaya yatkın olması gerekir.
Metal ametal atomlar arasında meydana gelir.
İyonik Bağ Oluşumu
Bu çekim kuvveti bir kimyasal bağdır ve bu bağa iyonik bağ denir.
Her iyon, zıt yüklü iyonlar tarafından (birbirlerini çekmesi sonucunda) sarılır ve bu şekilde yığınlar oluşur.
Bu tip bileşiklere iyonik bağlı bileşikler(kristal, yığın) denir.
Kovalent Bağ
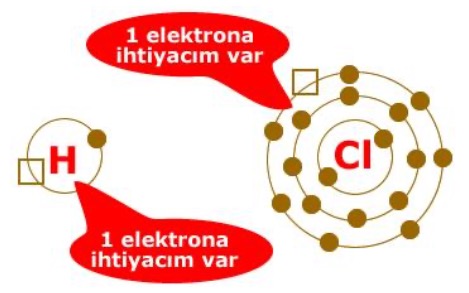
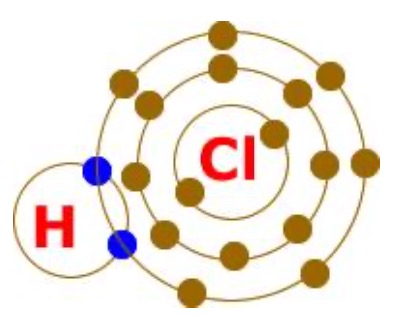
Kovalent bağ elektrona ihtiyacı olan atomlar arasında meydana gelir. Diğer bir ifade ile elektrona ihtiyacı olan atomların elektronlarını ortaklaşa kullanılması sonucunda oluşan kimyasal bağdır.
Ametal atomlar arasında meydana gelir.
Unutmayın! Bir atomun kaç elektrona ihtiyacı varsa o kadar elektronu ortaklık için kullanır.
Kovalent Bağ Sonucunda;
2. Molekül yapılı bileşikler oluşur.
Bileşik Nedir?
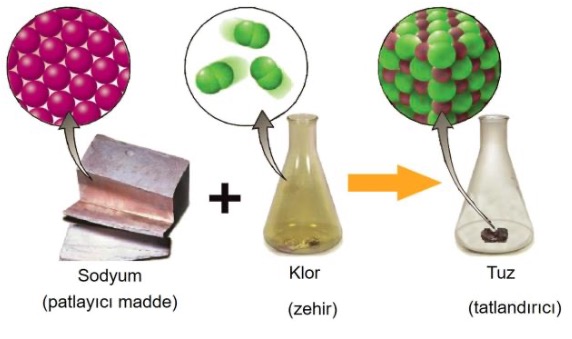
Farklı element atomlarının kimyasal bağlarla bir araya gelerek oluşturdukları yeni özelliklere sahip saf maddeye BiLEŞİK denir.
Bileşiği oluşturan element atomları bileşikten farklı özelliktedir.
Bileşiği oluşturan elementler, bileşiği oluştururken kendi özelliklerini kaybeder ve yepyeni özellik kazanırlar!
2019-11-27 Admin Admin
Taglar: PeriyodikCetvel’inTarihçesi
| Kimya Ders Notları - İlginizi çekebilecek başlıklar |
|---|
|
Bileşiklerin Oluşması ve Özellikleri
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik oluştururlar. |
|
Organik Kimya Ders Notları
Organik Kimya Ders Notları özetleri; Kuantum Sayilari ve Periyodik Sistem. Periyodik Özellikler ve Elementler. Gazlar. Çözelti Etkileşimleri ve Derişimleri. Kimyasal Tepkimelerde Enerji |
|
Katlı Oranlar Kanunu
“iki element aralarında birden fazla bileşik oluşturuyorsa, bunlardan birinin sabit miktarıyla birleşen ikincisinin değişen miktarları arasında basit tam sayılı bir oran bulunur.” Bu şekilde “Katlı Oranlar Kanunu” olarak bildiğimiz y |
|
Kütlenin Korunumu Kanunu
Kimyasal olaylarda, tepkimeye giren maddelerin kütleleri toplamı, tepkime sonunda oluşan maddelerin kütleleri toplamına eşittir. Bu olaya KÜTLENİN KORUNUMU KANUNU denir. |
|
Sabit Hacimler Kanunu
Kimyasal reaksiyona giren gaz halindeki element ya da bileşiklerin aynı basınç ve sıcaklık şartlarında hacimleri arasında tam sayılarla gösterilen bir oran vardır |


Sayfa Yorumları