Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava bulunan bir fanusa koyarak tartmış. Daha sonra fanusu içindekilerle birlikte ısıtmış ,ısınan kalayın beyaz bir toz haline ( Sn O )doÌnuÌştuÌgÌuÌnuÌ goÌzlemlemiştir. Oluşan beyaz tozu ve fanusu tekrar tarttıgÌında başlangıçta belirledigÌi kuÌtle ile eşit oldugÌunu goÌzlemlemiştir.
Benzer deneylerle aynı sonuca ulaşmıştır. Oluşan beyaz tozu (Kalay oksit ) benzer yolla ısıttıgÌında ise başlangıçta fanusa koydugÌu Kalayın kuÌtlesin eşit kuÌtlede kalay elde ettigÌini goÌzluÌyor ve kendisini unutulmaz yapan şu sonuca varıyor.â
Madde yoktan var edilemedigÌi gibi, vardan da yok edilemez. Sadece birinden oÌtekine doÌnuÌşebilirâ
Bu ifadesi "KuÌtlenin Korunumu Yasası" diye bilinir
Bu guÌnkuÌ ifadesi ile;
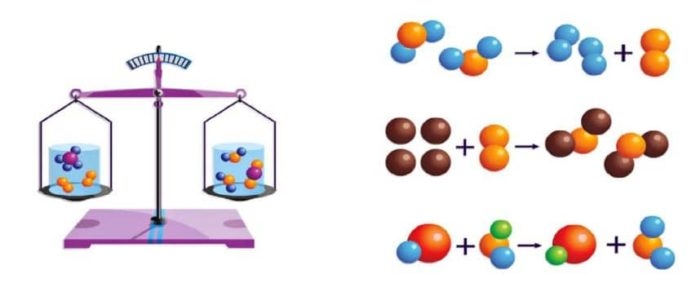
Kimyasal olaylarda, tepkimeye giren maddelerin kuÌtleleri toplamı, tepkime sonunda oluşan maddelerin kuÌtleleri toplamına eşittir. Bu olaya KUÌTLENIÌN KORUNUMU KANUNU denir.
KuÌtlenin Korunumu Kanunu
1. Erime,donma,buharlaşma,yogÌunlaşma gibi hal degÌişimleri ile çoÌzuÌnme gibi fiziksel olaylarda da korunur.
2. Kimyasal olaylara giren maddelerin kuÌtleleri toplamı, elde edilen uÌruÌnlerin kuÌtleleri toplamına eşittir.
OÌRNEK;
Bir parça magnezyumun tuÌmuÌ 98 gr suÌlfuÌrik asit ile tepkimeye giriyor. Oluşan magnezyum suÌlfatın kuÌtlesi 120 gr ve açıgÌa çıkan hidrojenin kuÌtlesi ise 2 gr oldugÌuna goÌre kullanılan magnezyum kaç gramdır.
Magnezyumun kuÌtlesi + SuÌlfuÌrik Asidin kuÌtlesi = Magnezyumun suÌlfatın kuÌtlesi + Hidrojenin kuÌtlesi
? + 98 = 120gr + 2gr
KuÌtlenin korunumu kanununa goÌre;
Magnezyumun kuÌtlesi + 98 = 120 + 2
Magnezyumun kuÌtlesi = 24 gr dır.
Benzer deneylerle aynı sonuca ulaşmıştır. Oluşan beyaz tozu (Kalay oksit ) benzer yolla ısıttıgÌında ise başlangıçta fanusa koydugÌu Kalayın kuÌtlesin eşit kuÌtlede kalay elde ettigÌini goÌzluÌyor ve kendisini unutulmaz yapan şu sonuca varıyor.â
Madde yoktan var edilemedigÌi gibi, vardan da yok edilemez. Sadece birinden oÌtekine doÌnuÌşebilirâ
Bu ifadesi "KuÌtlenin Korunumu Yasası" diye bilinir
Bu guÌnkuÌ ifadesi ile;
Kimyasal olaylarda, tepkimeye giren maddelerin kuÌtleleri toplamı, tepkime sonunda oluşan maddelerin kuÌtleleri toplamına eşittir. Bu olaya KUÌTLENIÌN KORUNUMU KANUNU denir.
KuÌtlenin Korunumu Kanunu
1. Erime,donma,buharlaşma,yogÌunlaşma gibi hal degÌişimleri ile çoÌzuÌnme gibi fiziksel olaylarda da korunur.
2. Kimyasal olaylara giren maddelerin kuÌtleleri toplamı, elde edilen uÌruÌnlerin kuÌtleleri toplamına eşittir.
OÌRNEK;
Bir parça magnezyumun tuÌmuÌ 98 gr suÌlfuÌrik asit ile tepkimeye giriyor. Oluşan magnezyum suÌlfatın kuÌtlesi 120 gr ve açıgÌa çıkan hidrojenin kuÌtlesi ise 2 gr oldugÌuna goÌre kullanılan magnezyum kaç gramdır.
Magnezyumun kuÌtlesi + SuÌlfuÌrik Asidin kuÌtlesi = Magnezyumun suÌlfatın kuÌtlesi + Hidrojenin kuÌtlesi
? + 98 = 120gr + 2gr
KuÌtlenin korunumu kanununa goÌre;
Magnezyumun kuÌtlesi + 98 = 120 + 2
Magnezyumun kuÌtlesi = 24 gr dır.
OÌRNEK;
40 ml KuÌkuÌrt di oksit gazının 32 gr oksijenle tepkimesinden 160 gr KuÌkuÌrt tri oksit oluştugÌuna goÌre KuÌkuÌrt di oksitin aynı koşullarda oÌz kuÌtlesi nedir?
KuÌkuÌrt di oksit gazı kuÌtlesi + oksijen gazı kuÌtlesi = ? + 32 gr
KuÌkuÌrt di oksit gazı kuÌtlesi + 32 = 160
KuÌkuÌrt di oksit gazı kuÌtlesi = 128 gr
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = m / V
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = 128 gr / 40mlt
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = 3.2 gr / mlt
OÌRNEK;
KuÌkuÌrt di oksit gazı kuÌtlesi + 32 = 160
KuÌkuÌrt di oksit gazı kuÌtlesi = 128 gr
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = m / V
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = 128 gr / 40mlt
KuÌkuÌrt di oksit gazı oÌz kuÌtlesi = 3.2 gr / mlt
OÌRNEK;
KuÌkuÌrt tri oksit gazı kuÌtlesi = 160 gr
Saf olmayan 8 gr magnezyum 14,6 gr hidroklorik asitle reaksiyondan 19 gr magnezyum kloruÌr ile 0,4 gr hidrojen gazı oluşuyor. Magnezyumun yuÌzde kaçı reaksiyona girmiştir?
Mgâmun kuÌtlesi + Hidroklorik Asidin kuÌtlesi = Mgâmun kloruÌruÌn kuÌtlesi + Hidrojen gazının kuÌtlesi
? + 14,6 gr = 19 gr + 0,4 gr
KuÌtlenin korunumu kanununa goÌre;
Magnezyumun kuÌtlesi + 14,6 = 19 + 0,4
Magnezyumun kuÌtlesi = 4,8 grâdır
8 gr Magnezyumdan kimyasal reaksiyona giren magnezyum kuÌtlesi 4,8 gr dır
100 gr Magnezyumdan kaç gr magnezyum reaksiyona girer?
8 gr â 4,8 gr
100 â ?
? = (100 x 4,8) / 8
? = % 60 â reaksiyona girmiştir.
Mgâmun kuÌtlesi + Hidroklorik Asidin kuÌtlesi = Mgâmun kloruÌruÌn kuÌtlesi + Hidrojen gazının kuÌtlesi
? + 14,6 gr = 19 gr + 0,4 gr
KuÌtlenin korunumu kanununa goÌre;
Magnezyumun kuÌtlesi + 14,6 = 19 + 0,4
Magnezyumun kuÌtlesi = 4,8 grâdır
8 gr Magnezyumdan kimyasal reaksiyona giren magnezyum kuÌtlesi 4,8 gr dır
100 gr Magnezyumdan kaç gr magnezyum reaksiyona girer?
8 gr â 4,8 gr
100 â ?
? = (100 x 4,8) / 8
? = % 60 â reaksiyona girmiştir.
2019-11-27 Admin Admin
Taglar: KĂŒtleninKorunumuKanunu
| Kimya Ders Notları - Ä°lginizi çekebilecek baĆlıklar |
|---|
|
BileĆiklerin OluĆması ve Ăzellikleri
GĂŒnĂŒmĂŒzde bilinen 117 element olmasına raÄmen (92 tanesi doÄada bulunur) bu elementler farklı sayıda ve Ćekilde birleĆerek ve etkileĆerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileĆik oluĆtururlar. |
|
Katlı Oranlar Kanunu
âiki element aralarında birden fazla bileĆik oluĆturuyorsa, bunlardan birinin sabit miktarıyla birleĆen ikincisinin deÄiĆen miktarları arasında basit tam sayılı bir oran bulunur.â Bu Ćekilde âKatlı Oranlar Kanunuâ olarak bildiÄimiz y |
|
Organik Kimya Ders Notları
Organik Kimya Ders Notları özetleri; Kuantum Sayilari ve Periyodik Sistem. Periyodik Ăzellikler ve Elementler. Gazlar. Ăözelti EtkileĆimleri ve DeriĆimleri. Kimyasal Tepkimelerde Enerji |


Sayfa Yorumları