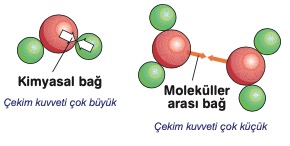
Molekülü oluşturan atomlar arasında kimyasal bağlar bulunduğunu biliyoruz. Bu bağlara sebep olan çekim kuvvetleri oldukça büyüktür.
Maddeyi oluşturan tanecikler birbirlerine uyguladıkları çekim kuvveti ile aralarında moleküller arası bağ oluşturur. Bu bağ sayesinde tanecikler bir arada bulunur. Tanecikler arasındaki çekim kuvveti atomlar arasındaki çekim kuvvetine göre oldukça zayıftır.
Isıtılan veya soğutulan bir madde hâl değiştirebilir. Maddeyi oluşturan moleküller arasındaki çekim kuvveti maddenin fiziksel hâlini belirler. Bir madde ısıtıldıkça moleküller arası uzaklık artar ve aralarındaki çekim kuvveti azalır. Bir seviyeden sonra madde hâl değiştirebilir.
Madde katı hâlde iken taneciker arasındaki çekim kuvveti en fazla, gaz hâlde iken çekim kuvveti yok denecek kadar azdır. Madde hâl değiştirdiğinde çekim kuvveti de değişir.
 |
 |
Erime ve Donma
Sabit atmosfer basıncı altında bütün katı maddelerin katı hâlden sıvı hâle geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine erime sıcaklığı ya da erime sıcaklık noktası denir.Sabit atmosfer basıncı altında her maddenin erime sıcaklığı farklı olduğu için maddeler için ayırt edici bir özelliktir. Örneğin deniz düzeyinde buzun erime sıcaklığı 0 °C tır.
Erime sıcaklığındaki 1 gram saf katı maddenin sıvı hâle geçmesi için gereken ısı miktarına o maddenin erime ısısı denir.
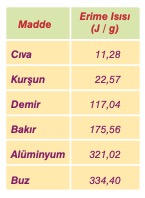
Her maddenin erime ısısı farklıdır. Dolayısıyla erime ısısı ayırt edici bir özelliktir. Erime ısısı Le ile gösterilir, birimi J/g dır. 0 °C taki 1 g buz eriyerek 0 °C ta su olması için buza 334,40 Joule enerji verilmesi gerekir.
Bazı maddelerin erime ısısı değerleri yandaki tabloda verilmiştir. Farklı mad-delerin eşit miktarlarını eritmek için gereken ısı miktarları da farklı farklıdır.
Bir katı maddenin eritilebilmesi için gereken ısı miktarı, maddenin küt-lesi ile doğru orantılıdır. Maddenin kütlesi arttıkça erimesi için alması gereken ısı da artar. Bu ısı mıktarını aşağıdaki bağıntı ile hesaplayabiliriz:
Q = m x Le
Katı bir madde erirken ne kadar ısı alırsa aynı miktar ısıyı donarken çevresine geri verir. Bundan dolayı maddelerin donma ve erime ısıları birbirine eşittir.
Donma sıcaklığındaki 1 g saf sıvı maddenin katı hâle geçmesi için çevreye verdiği ısı miktarına donma ısısı adı verilir. Donma ısısı Ld harfiyle gösterilir.
Basıncın Erime ve Donmaya Etkisi
Basınç, birim yüzeye etkiyen dik kuvvettir. Bundan dolayı basınç, bir maddenin moleküllerini bir arada tutarak parçalanıp dağılmasını önleyecek yönde etkir.* Erime sırasında hacmi artan maddelerde, basıncın artması erimeyi zorlaştırır. Maddenin erime sıcaklığı basınçla yükselmiş olur. Tersinde ise azalmış olur.
* Erime sırasında hacmi azalan maddelerde basıncın artması erimeyi kolaylaştırır. Böylece maddenin erime sıcaklığı düşer.
Örneğin normal şartlarda 0 °C ta eriyen buz, üzerine basınç uygulandığında – 1 °C, – 2 °C ta eriyebilir. Kışın kar üzerine bastığımızda, ayağımızın altındaki karın erimeye başlaması buna bir örnektir.
Safsızlığın Erime ve Donmaya Etkisi
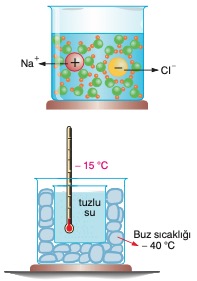 Bir miktar tuzu bir bardak su içine döküp karıştıralım. Oluşan tuzlu su çözeltisini soğumaya bırakalım. Tuzlu suyun 0 °C ta değil daha düşük bir sıcaklıkta donduğunu görürüz. Bunun sebebi katkı maddelerinin sıvıların saflığını bozmasıdır. Örneğin suya karıştırılan tuz bileşiği, klor ve sodyum iyonlarına ayrışır ve bunlar su moleküllerinin arasına girer. Böylece suyun saflığı bozulur. Karıştırılan tuz miktarına göre tuzlu suyun donma sıcaklığı –15 °C lara kadar düşebilir.
Bir miktar tuzu bir bardak su içine döküp karıştıralım. Oluşan tuzlu su çözeltisini soğumaya bırakalım. Tuzlu suyun 0 °C ta değil daha düşük bir sıcaklıkta donduğunu görürüz. Bunun sebebi katkı maddelerinin sıvıların saflığını bozmasıdır. Örneğin suya karıştırılan tuz bileşiği, klor ve sodyum iyonlarına ayrışır ve bunlar su moleküllerinin arasına girer. Böylece suyun saflığı bozulur. Karıştırılan tuz miktarına göre tuzlu suyun donma sıcaklığı –15 °C lara kadar düşebilir.Dondurucu soğuğa rağmen deniz ve okyanus suları niçin hemen donmaz? Çünkü denizlerdeki su kütlesi hem çok büyüktür hem de sular tuzludur. Fakat göllerdeki su tatlı sudur. Dolayısıyla hava sıcaklığı 0 °C ın altına düştüğünde göl ve nehir suları donar. Kutuplarda hava sıcaklığı 0 °C un altında olsa bile tuzlu deniz suyu çok daha düşük sıcaklıklarda donar.
Uyarı
* Madde hâl değiştirirken sıcaklığı değişmez.* Bir maddenin erime sıcaklığı ile donma sıcaklığı eşittir.
* Bir maddenin erime ısısı ile donma ısısı eşittir.
* Erime sıcaklığı ve erime ısısı, maddenin ayırt edici özelliklerindendir.
Buharlaşma
Sıvıların gaz hâline geçmesi olayına buharlaşma denir. Buharlaşmada basınç ve diğer fiziksel şartların etkisi çoktur. Sıvı ısıtıldığında moleküllerin hızı artar. Hızla sıvı yüzeyine ulaşan molekül, moleküller arası çekim kuvvetini yenerek sıvıyı terkeder. Bu olaya buharlaşma denir.* Buharlaşma her sıcaklıkta olabilir.
* Maddeler dışarıdan ısı alarak buharlaşır. Dolayısıyla buharlaşmanın olduğu yerde serinleme ve soğuma olur.
* Sıcaklığın artması buharlaşmayı hızlandırır.
* Açık hava basıncının azalması buharlaşmayı artırır.
* Sıvının açık yüzey alanı arttıkça buharlaşma daha fazla olur.
* Rüzgarlı havada buharlaşma fazla olduğundan ıslak çamaşırlar daha çabuk kurur.
Kaynama ve Yoğuşma
 Bir kapta bulunan sıvı ısıtılırsa sıcaklığı yükselir ve buharlaşma artar. Sıvının sıcaklığının yükselmesiyle meydana gelen buhar basıncı, sıvının yüzeyine etki eden basınca eşit olduğu an, sıvı kaynamaya başlar. Kaynama sırasında sıvının sıcaklığı değişmez.
Bir kapta bulunan sıvı ısıtılırsa sıcaklığı yükselir ve buharlaşma artar. Sıvının sıcaklığının yükselmesiyle meydana gelen buhar basıncı, sıvının yüzeyine etki eden basınca eşit olduğu an, sıvı kaynamaya başlar. Kaynama sırasında sıvının sıcaklığı değişmez.Sabit atmosfer basıncı altında bütün sıvı maddelerin, sıvı hâlden gaz hâle geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine kaynama noktası denir. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.
Kaynama sıcaklığındaki 1 gram saf sıvıyı gaz hâle geçirmek için gerekli ısıya buharlaşma ısısı denir. Buharlaşma ısısı “Lb” şeklinde ifade edilir. Bir sıvının buharlaşması için gereken ısı miktarı sıvının kütlesiyle doğru orantılıdır. Kaynama sıcaklığında kütlesi arttıkça, sıvının buharlaşarak gaz hâle geçmesi için ihtiyaç duyduğu ısı enerjisi de artar. Buharlaşma için gerekli ısı enerjisi aşağıdaki bağıntıyla hesaplanır.
Q = m x Lb
Kütle birimi kilogram, ısı birimi Joule olduğunda buharlaşma ısısı birimi Joule/gram (J/g) olur.
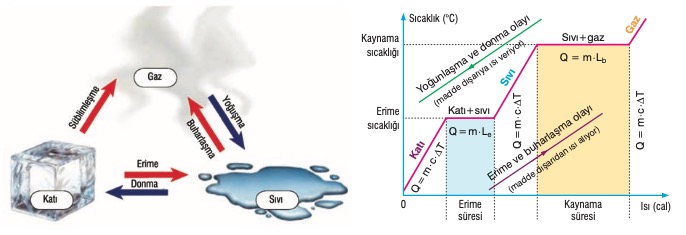
Suyun Hâl Değişim Grafiği
Bir parça buz ısıtıldığında önce sıcaklık artar. Erime sıcaklığına geldiğinde hâl değiştirmeye başlar ve buzun tamamı eriyinceye kadar sıcaklığı değişmez. Isı ener-jisi verilmeye devam edildiğinde, suyun sıcaklığı artar ve 100 °C ta kaynamaya başlar. Suyun tamamı buhar oluncaya kadar sıcaklık değişmez. Bu açıklamaya göre buzun sıcaklık - alınan ısı grafiği şekildeki gibi olur.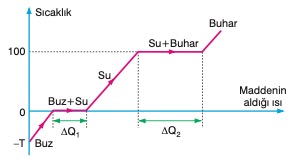
Buzun erime ısısı Le = 334,4 J/g, buharlaşma ısısı Lb = 2257 J/g olduğundan, 0 °C taki 1 gram buzu eritmek için 334,4 J ısı gerekirken, 100 °C taki 1 gram suyu gaz hâline geçirmek için 2257 J gerekir. Bundan dolayı DQ1 < DQ2 dir.
2019-12-28 Admin Admin
Taglar: Değişimi
| Isı - Sıcaklık ve Genleşme - İlginizi çekebilecek başlıklar |
|---|
|
Basınç, Sıcaklık ve Hâl Değişimi Arasındaki İlişki
Bir madde belirli sıcaklık ve basınç değerlerinde aynı ortamda hem sıvı hem katı hâlde bulunabilir. Bununla birlikte bir madde belirli sıcaklık ve basınç değerlerinde aynı ortamda hem sıvı hem gaz hâlde de bulunabilir. |
|
Gazlarda Genleşme
Isıtılan gazlar genleşir. Gaz moleküllerinin kinetik enerjileri artar. Bu da gaz moleküllerinin arasındaki uzaklığın artmasına neden olur. |
|
Genleşme ve Büzülme
Isıtılan bütün maddelerin boylarında uzama, yüzeylerinde genişleme ve hacimlerinde artma olur. Günlük hayatımızda değişik yerlerde, örneğin elektrik tellerinin kışın gergin yazın sarkık olması, tren rayları döşenirken bir miktar bo |
|
Fizikte İç Enerji
Bir maddenin taneciklerinin sahip olduğu tüm enerjilerinin toplamına iç enerji denir. İç enerjiye madde taneciklerinin öteleme, dönme ve titreşimden kaynaklanan kinetik enerji, moleküllerdeki potansiyel enerji ile moleküllerin birbiriyle etkile |
|
Fizikte Isı Enerjisi
Sıcaklıkları farklı olan maddeler arasında alınıp verilen, diğer bir ifadeyle transfer edilen enerjiye ısı enerjisi denir. Isının bir maddeden diğerine aktarımına ısı alışverişi denir. |
|
Fizikte Isı Sığası
Bir maddenin kütlesi ile özgül ısısının çarpımına (m * c) ısı sığası denir. Isı sığası madde miktarına bağlı olup ayırt edici özellik değildir. |



"0 °C taki 1 gram buzu eritmek için 334,4 J ısı gerekirken, 100 °C taki 1 gram suyu gaz hâline geçirmek için 2257 J gerekir." ifadesine dayanarak; buzun erimesi için gereken sıcaklık değerinin, enerjiler arası doğru orantı ile 14.81 °C çıkıyor. Buda demek oluyor ki, kıştan kalan sokak buzlarının erimesi için, havanın yaklaşık 15 °C ısınması gerekiyor. Bu yaklaşım doğru mudur?